糖原贮积病(glycogen storage disease,GSD)是一类先天性酶缺陷所造成的糖原代谢障碍疾病,糖原贮积病Ⅳ型(glycogen storage disease type Ⅳ)又称支链淀粉病(amylopectinosis)、Andersen病(Andersens disease),是由淀粉1,4-1,6转葡萄糖苷酶缺陷所致。在病人的肝,肾、脾、肌肉及神经系统均有异常的糖原贮积,尤以肝细胞中贮积量最多,检查肝、白细胞及成纤维细胞的分支酶可确定诊断,智能正常。本病无特殊治疗,仅作对症处理。
-
挂什么科:儿科 儿科综合
-
需做检查:胰高糖素激发试验 尿常规 脾脏超声检查 肌电图 脑电图检查 心电图 果糖耐量试验 血常规 肝脏超声检查 肾上腺素试验
-
治疗方法:药物治疗 手术治疗 支持性治疗
-
常用药物:暂无相关信息
-
一般费用:根据不同医院,收费标准不一致,市三甲医院约(10000 —— 10000元)
-
传染性:无传染性
-
治愈周期:2-4个月
-
治愈率:60%
-
患病比例:0.005%
-
好发人群:儿童
-
相关症状:
-
相关疾病:
患儿在出生后数月内常可无任何症状,而在3~15个月时逐渐出现肝,脾大,腹部膨胀,消化道症状和体重不增等情况,并可能有肌张力低下,肌肉消瘦和萎缩,深腱反射消失等神经系症状,随着病情进展,肝硬化和门脉高压征象逐渐明显,出现腹水,腹壁静脉怒张和食管静脉曲张,黄疸等,患儿甚易并发各种感染,常在3~4岁以内死于慢性肝功能衰竭。
分支酶缺陷的临床表现是多种多样的,近年已有少数经酶活性检测证实的成人病例报道,这些患者都是以神经,肌肉疾病症状为主,已知这类患者的外周神经组织和白细胞中的分支酶活力下降,随着资料的累积,将会有进一步认识。
(一)发病原因
本型是由于分支酶(brancher enzyme)缺陷所致,分支酶的编码基因(GBE1)位于3p12,根据现有资料分析,本病为常染色体隐性遗传病,但因患儿绝大多数为男性,故性连锁遗传的可能性尚不能除外。
(二)发病机制
分支酶又称为α-1,4-葡聚糖:α-1,4-葡聚糖-6-葡糖基转移酶(α-1,4-glucan-6-glycosyl transferase),是糖原合成途径中必需的酶,缺乏此酶使糖原合成时形成的直链增长,分支点锐减,糖原分子结构近似植物的支链淀粉而难溶于水,这种结构异常的糖原分子导致了肝脏严重的进行性损害,其机制尚不清楚,约半数本病患儿可同时有心肌,骨骼肌,中枢神经系统等损害,甚至有少数患者以肌肉,神经系统病变为主,因此,目前推测分支酶可能有两种从属于不同器官的同工酶,不同患者的临床表现取决于其酶缺陷的种类,这样,也可能解释了为什么这种结构异常的糖原分子,中仍然有少量分支点(1,6糖苷键)存在。
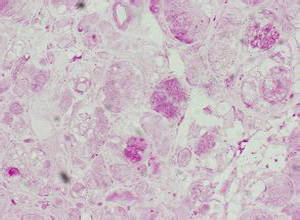
肝脏呈现结节性硬化,肝细胞排列不规则,纤维组织增生,肝细胞浆内无色或染色较浅的包涵体沉积,其边缘与胞浆分界明显,包涵体内呈玻璃样或网状结构,细胞核常偏于一旁,电镜检查和组织化学染色可显示异常结构的糖原。
根据临床特点和实验室检查确诊。
鉴别诊断
1.与GSD-Ⅰ鉴别:本型的肝组织病理变化与GSD-Ⅰ者类似,但本型甚少脂肪变性,且纤维化明显,临床上不累及肾脏,甚少发生严重低血糖,心衰和心律失常罕见,可资鉴别。
2.与von Gierke病相鉴别:可用胰高血糖素试验。正常人注射胰高血糖素30min之内,血糖至少增高3.9mmol/L;而von Gierke病血糖增高<1.7mmol/L,空腹和进食后皆如此,依此可与GSD-Ⅲ相鉴别,后者如在进餐后2h给予胰高血糖素,血糖浓度将明显增高。肾上腺素耐量试验并不优于胰高血糖素耐量试验,并可能引起不良副作用。给von Gierke病人进食半乳糖或果糖不导致血糖水平增高,此种耐量试验当尽量不做,因可导致严重酸中毒。
小儿糖原贮积病Ⅳ型西医治疗
目前医学界对本病除一般支持治疗外,尚无有效治疗方法。已证实饮食疗法:高蛋白、高脂肪、低碳水化合物饮食,胰高糖素和α-葡糖苷酶等对本病无效。对病损仅限于肝脏者,可考虑肝移植术。
预后
本症预后差,多在早期死亡。
小儿糖原贮积病Ⅳ型中医治疗
暂无可参考资料。
以上提供资料及其内容仅供参考,详细需要咨询医生。
日常保健
选择营养价值高的植物或动物蛋白,如牛奶、蛋类、鱼类、瘦肉、各种豆制品等。
检测培养羊水细胞或绒毛细胞中的分支酶活力可供产前诊断,必要时终止妊娠。
本病常无低血糖表现,口服葡萄糖和果糖耐量试验亦正常,胰高糖素或肾上腺素试验可使血糖轻度上升(0.8~1.3mmol/L),峰值常在30min时出现,血清胆固醇轻度增高,血清转氨酶和碱性磷酸酶活力显著增高,血清蛋白质和血氨等常随肝功能恶化而异常,酶活性检测可采用肝,肌组织或红,白细胞进行。
常规做X线胸片,B超,心电图和肌电图,脑电图检查,一般可见肝脏增大,脾脏增大,可发现腹水,肝硬化,食管静脉曲张等,肌电图,脑电图检查异常。
体重不增,可发生肝硬化和门脉高压,出现腹水,腹壁静脉曲张和食管静脉曲张,黄疸等,易并发各种感染,死于慢性肝功能衰竭。