进行性肌营养不良症(progressive myodystrophy)是一组由遗传因素所致的原发性骨骼肌疾病,其临床主要表现为缓慢进行的肌肉萎缩,肌无力及不同程度的运动障碍。本病可由多种遗传方式引起,其临床表现各具有不同的特点,因而形成许多类型。本病可由多种遗传方式引起,多发生于儿童和青少年。
传统分为以下类型:
1.假性肥大型肌营养不良(pseudohypertrophic muscular dystrophy)
X性连锁隐性遗传,基因位点在Xp21,基因的缺陷可导致骨骼肌中其编码蛋白dystrophin的缺乏,分为Duchenne和Becker两型,前者起病年龄早,病情重,进展快,dystrophin几乎缺如;后者起病年龄较迟,病情相对较良性,dystrophin量减少或有质的改变。
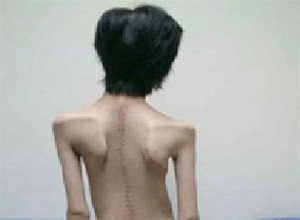
(1)Duxhenne型(Duchenne muscular dystrophy,DMD):是肌营养不良中发病率最高,病情最为严重的一型,常早年致残并导致死亡,故称为“严重型”,几乎所有患者均为男孩,女孩患病极为罕见,多在3岁之后发病,可见患儿动作笨拙,跑,跳等均不及同龄小孩,因骨盆带及股四头肌等无力,致使行走缓慢,易跌倒,登楼上坡困难,下蹲或跌倒后起立费劲;站立时腰椎过度前凸,步行时挺腹和骨盆摆动呈“鸭步”样步态,仰卧起立时,必须先翻身与俯卧,以双手撑地再扶撑于双膝上,然后慢慢起立,称Gower征,随病情发展累及肩带及上臂肌时,则双臂上举无力,呈翼状肩胛,萎缩无力的肌肉呈进行性加重,并可波及肋间肌等,假性肌肥大最常见于双侧腓肠肌,因肌纤维被结缔组织和脂肪所取代,变得肥大而坚硬,假肥大也可见于三角肌,股四头肌等其他部位的肌肉,肌腱反射减弱或消失,随肌萎缩无力之加重及关节活动的减少,可出现肌腱挛缩及关节强硬畸形,大约在12岁左右便不能站立和行走,不少患儿伴心肌病变,心电图多有异常,如高R波,Q波加深等,部分患儿智力低下,大约在20岁左右,病人多因呼吸衰竭,肺部感染及心力衰竭等原因而死亡。
(2)Becker型(Beker muscular dystrophy,BMD):与DMD相似,区别要点主要在于病程长,发展相对缓慢,有一段正常的生活期,故称之为“良性型”,本型一般在5~20岁发病,大约在出现症状后20余年才不能行走,四肢近端肌肉萎缩无力,尤以下肢明显,腓肠肌肥大常为早期征象,心肌受损及关节挛缩畸形较少见,智力一般正常,大多可存活至40~50岁。
2.Emery-Dreifuss肌营养不良
是一种少见的良性X连锁隐性遗传病,多于2~10岁发病,初期常表现上肢近端及肩胛带肌无力,数年后逐渐累及骨盆带及下肢远端肌群,一般以胫骨前肌和腓骨肌无力和萎缩最为明显,少数可伴有面肌轻度无力,本型常在早期出现颈,肘,膝,踝关节挛缩,几乎所有病人均伴有不同程度的心脏损害,可由心脏传导阻滞而突然致死。
3.面肩肱型肌营养不良(facioscapulohumeral muscular dystrophy,FSHD)
为常染色体显性遗传病,男女均可罹患,发病年龄差异很大,一般为5~20岁。
病变主要侵犯面肌,肩胛带及上臂肌群,面肌受累时表现面部表情淡漠,闭眼,示齿力弱,不能蹙眉,皱额,鼓气,吹哨等,由于常合并口轮匝肌的假性肥大,以致上下嘴唇增厚而微噘,同时病变会延及双侧肩胛带及臂肌群,常为不对称性,以致患者双臂不能上举,外展不能过头,出现梳头,洗脸,穿衣等困难,由于肩胛带肌无力萎缩,表现明显的翼状肩,有的表现游离肩或“衣架样肩胛”,可见三角肌,腓肠肌假性肥大,心肌受累罕见,晚期才累及骨盆带肌群,病情进展缓慢,一般预后较好。
4.肢带型肌营养不良(limb girdle muscular dystrophy,LGMD)
以往由于对该类病变认识甚少,只是根据临床症状和遗传方式来分型的,随着分子生物学研究的深入,Bushby和Beckmann(1995)根据基因分析的结果,对LGMD提出一个全新的分型命名,他们按遗传方式将LGMD分为两型:LGMD1代表常染色显性遗传,LGMD2代表常染色体隐性遗传;并在LGMD1或LGMD2后加字母表示不同的致病基因所导致的相应亚型,截止目前,LGMD1分为LGMD1A,1B和1C 3种类型;LGMD2则分LGMD2A,2B,2C,2D,2E,2F,2G和2H,共8种类型,在LGMD中,90%以上为LGMD2。
现将其中较常见的类型简述如下:
(1)LGMD1A型:基因定位于5q22.3-q31.3,其编码蛋白为myotilin,多在青壮年期间发病,初期表现为四肢近端无力,逐渐累及肢体远端,后期见有踝关节挛缩,病情进展缓慢,最终失去行走能力,血清CPK水平升高,EMG呈肌源性损害。
(2)LGMD2A:基因定位于15q15.1-p121.1,其编码蛋白为calpain-3,临床严重程度不一,大部分表现较轻,发病年龄4~15岁,主要表现为双下肢近端无力,呈对称性,后累及肩胛带肌群,多于30岁左右丧失行走能力,有些患者可有腓肠肌假性肥大,但程度较轻,后期可有小腿肌挛缩,脊柱强直,血清CPK水平明显升高。
(3)LGMD2C (重型儿童常染色体隐性遗传性肌营养不良,SCARMD):基因定位于13q12,编码蛋白为r-sarcoglycan,病情严重,部分病例有类似DMD的病程,其他多介于DMD和BMD之间,发病年龄为3~12岁,首先侵犯骨盆带肌,以后波及胸部,颈部肌,尚伴有心肌受累,一般不影响智力,多有腓肠肌假性肥大,常于10~13岁丧失行走能力,30~40岁出现呼吸衰竭,血清CPK水平明显升高。
5.眼咽型肌营养不良(oculopharyngeal muscular dystrophy)
属常染色体显性遗传性肌病,多在40岁左右起病,首先出现对称性眼外肌无力和(或)眼睑下垂,后逐渐表现吞咽,构音困难,进展十分缓慢,少数患者以吞咽障碍作为首发症状,尚有些患者伴有轻度的面肌,咬肌,颞肌以及肢带肌等的无力和萎缩。
6.远端型肌营养不良(distal muscular dystrophy)
目前已将该型肌营养不良至少分为4个亚型,即常染色体显性遗传Ⅰ型,Ⅱ型及常染色体隐性遗传Ⅰ型,Ⅱ型,前者多出现在欧洲,而日本报道的病例多为常染色体隐性遗传Ⅰ型和Ⅱ型,该类肌病的共同特点是:肌无力主要表现在四肢的远端,以伸肌的无力和萎缩最明显;无感觉障碍及自主神经损害的表现;肌电图为肌源性损害,其中有些类型的病理学检查与遗传性包涵体肌病相似。
7.强直性肌营养不良(myotonic dystrophy)
本病为常染色体隐性遗传,致病基因定位于19q13.3,编码蛋白为强直性肌营养不良蛋白激酶(myotonic dystrophy protein kinase,MDRK)或称DM-kinase(DMK),正常健康人的DMK有5~37个CAG核苷酸重复序列,而强直性肌营养不良患者该基因CAG重复可达50~300个,此类由于三核苷酸串重复导致的疾病统称为三核苷酸重复疾病(triplet repeat diseases),本病的病理特点与其他类型的肌营养不良不同,肌纤维坏死和再生少见,而主要改变为肌纤维周边大量的肌浆块形成,内核肌纤维明显增多,纵切面可见核链形成,此外还可有选择性Ⅰ型纤维萎缩,因此现在有一种观点认为强直型肌营养不良在分类上不属于肌营养不良,而属强直性肌病的范畴。
本病又称营养不良性肌强直(dystrophia myotonica),临床分为成人型,先天型和轻症型三种类型,发病年龄和疾病的严重程度有关,发病越早,临床症状越重,头面诸肌,颈肌和四肢远端肌肉受累较重,表现为双睑下垂,咬肌和颊肌萎缩形成特有的“斧型脸”;胸锁乳突肌萎缩无力致使颈部弯曲,过度前倾,形成“天鹅颈”,早期即可有胫骨前肌无力,萎缩和足下垂,咽喉肌受累可导致鼻音,语音单调,声音低钝,食管上部骨骼肌受累可引起食管扩张,随病情进展,近端肌群和骨骼肌也受累,腱反射低下或消失,肌强直表现为轻轻叩击或电刺激后,肌肉出现自发性长时间收缩,大鱼际肌,舌肌和眼轮匝肌容易诱发,强直症状可先于肌肉无力多年出现,有些患者早期可能被误诊为先天性肌强直,先天型和婴儿期发病的强直型肌营养不良,早期较长的一段时间内可无肌强直症状,有些甚至在20~30岁以后才出现,本病多在15~20岁丧失行走能力,多数患者不能存活到正常寿命。
强直型肌营养不良为多系统损害疾病,除肌萎缩,肌无力和肌强直外,还有内分泌系统损害如阳痿,脱发,睾丸萎缩,乳房肿大和卵巢功能下降;心脏损害如心律失常,房室传导阻滞;神经精神损害如精神发育迟滞,遗忘,多疑;眼部损害如晶体浑浊和白内障(见于90%的患者),有些患者还可以伴有运动感觉性周围神经病。
(一)发病原因
本病的发病机制研究已为世人所瞩目,数十年来,相继提出的有血管性,神经性,肌纤维再生错乱和细胞膜缺陷等学说,但大量的研究证据表明细胞膜缺陷在本病发生有重要地位,三分之一新生男婴患儿是由于基因突变所引起。
随着分子生物学研究的深入开展,本病的病因和发病机制有了进一步阐明,已明确本病是一类单基因遗传病,遗传方式多样,不少致病基因已得到定位和克隆,部分基因产物已得到阐明,有的致病基因尚不明,相关基因位点突变可引起其表达产物肌膜结构蛋白的缺陷和异常而致病。
对其不同类型,不同亚型的分子机制也有了新的认识,其中以Duchenne型和Becker型肌营养不良(DMD,BMD)的研究最为深入,DMD为X连锁隐性遗传病,致病基因已定位于X染色体短臂2区1带2~3亚带(Xp21.2~21.3),其基因的cDNA已经被克隆,全长为14kb,有60~65个外显子,基因表达产物为抗肌萎缩蛋白(dystrophin,Dys),当基因出现大片段缺失,重复或其他形式变异如点突变时,导致Dys缺如或结构功能异常是DMD致病的根本原因,BMD基因与DMD处于同一区域,互为等位基因,Dys位于肌纤维膜的内层,是一种细胞骨架蛋白,有稳定肌纤维膜的作用,在DMD患者中,由于肌纤维缺乏Dys,肌膜结构的完整性受到破坏,大量富含钙离子的细胞外成分流入肌细胞内,最终导致肌纤维变性,坏死而发病,Emery-Dreifuss肌营养不良的致病基因定位于xq28,其编码蛋白为emerin,近年来发现肢带型肌营养不良(LGMD)的发生与附着于肌纤维膜上的抗肌萎缩蛋白-糖蛋白复合物(dystrophin-glycoprotein complex,DGC)的遗传缺陷有关,DGC在维持肌纤维膜的稳定和防止膜损伤坏死起着十分重要的作用,面肩肱型肌营养不良(FSHD)为成年人最常见的常染体显性遗传肌病,其基因定位存4q35,基因尚未克隆,编码蛋白尚未分离,但已证明FSHD与4号染色体长臂末端3.3kb串联重复序列拷贝数的缺失有关,其他如远端型肌营养不良不同亚型的分子机制也有新的认识。
(二)发病机制
与肌营养不良发病有关的膜结构蛋白是由多种蛋白质组成的一个大复合物,称抗肌萎缩蛋白-糖蛋白复合物(dystrophin-glucoprotein complex,DGC),包括抗肌萎缩蛋白(dystrophin),肌营养不良聚糖复合物(由α,β-dystroglycan组成),肌聚糖复合物(α,β,γ,δ-sarcoglycan)和营养合成蛋白复合物(syntrophin complex),dystrophin的一端与肌动蛋白相联结,另一端与β-dystroglycan相联结,再通过α-dystroglycan与基底膜上的细胞外基质蛋白α2-Laminin相联结,在结构上起到了连接肌肉细胞内肌动蛋白和细胞外基质的桥梁作用,DGC的各组成分紧密结合,相互关联可维护肌膜的稳定性和完整性,当相应的基因位点发生突变,使DGC某一组份发生缺陷时,如dystrophin或任一型sarcoglycan的缺乏,都会影响整个膜结构的稳定,引起肌膜损伤,进而发生一连串反应并导致肌纤维坏死。
本病早期病理变化仅见肌纤维大小不等,内核增多,病变进展期表现肌纤维结构紊乱,大小悬殊明显,在同一肌束中萎缩纤维,撕裂纤维及肥大纤维呈不规则的混杂分布,光镜下见肌纤维粗细不等,肌纤维变性,坏死,如玻璃样变性,颗粒状变性,絮状变性及吞噬现象等,肌膜核内移,排列成链状,早期可见再生纤维,晚期肌纤维消失殆尽,由脂肪及结缔组织所代替。
以上病变以DMD最重,其他类型变化较轻,此外,心肌也有类似改变,肌肉组化染色显示Ⅰ,Ⅱ两型纤维均有受累,无同型肌群化现象,其中DMD常表现ⅡA纤维缺失,ⅡC纤维明显增加,后者提示再生过程的活跃,这固然是一种对坏死纤维代偿性修复的反应,但再生能力及其速度远不及坏死的发展,故其病情仍呈进行性加重。
电镜下见肌溶灶,肌质膜断裂,缺陷或完全消失,Z线模糊,肌浆网扩张增生有空泡形成,糖原颗粒增多,线粒体变性,间质结缔组织增生,冰冻蚀刻电镜扫描发现肌纤维膜蛋白颗粒数目明显减少,此在红细胞膜内也有类似变化,应用dystrophin单克隆抗体对DMD和BMD患者的肌肉标本进行免疫组化染色可见肌浆膜dystrophin部分或完全缺失。
根据临床症状和体征,参考家族遗传史,再加血清酶,肌电图和肌活检的阳性发现,常可确诊。
诊断要点
1.常有家族史。
2.病肌先累及四肢近端肌群,两侧对称有假性肥大,下肢无力,步态摇摆,Gower's 征阳性;上肢举臂困难。
3.皮肤知觉正常,腱反射及浅反射无亢进,无肌颤动。
4.血CPK 显著增高是最敏感指标,有助于早期诊断;ALT、AST、LDH 可有升高。
5.肌电图符合肌厚性损害;肌活检可见纤维变性;dystrophin 含量测定和PCR技术有助于诊断。
鉴别诊断
主要需与脊肌萎缩症,慢性多发性肌炎和线粒体肌病等进行鉴别,除临床病史和表现外,血清酶测定,肌电图和肌活检的结果在协助鉴别诊断上有重要价值。
1.少年型脊肌萎缩症(Kugelberg-Welander病)
一般为幼年期至青春起病,表现为进行性肢体近端肌无力和萎缩,故易与DMD/BMD相混淆,但本病男女均可罹患,多伴有肌束震颤,根据血清酶测定,肌电图及肌肉病理检查等特点,一般鉴别并不困难。
2.多发性肌炎
须与肢带型肌营养不良区别,多发性肌炎一般进展较快,肌无力的程度比肌萎缩明显,常有肌痛,无家族遗传史,且应用皮质类固醇治疗往往效果较好,通过肌肉活检可以明确鉴别。
3.重症肌无力
一般根据肌肉力弱呈波动性和易疲劳性,应用抗胆碱酯酶药物效应良好以及肌电图低频重复刺激出现递减现象等特点,作为与眼咽型肌营养不良进行鉴别。
进行性肌营养不良症西医治疗
(一)治疗
本病目前尚无特效的治疗方法。只能采取对症疗法及一般支持疗法,包括应用维生素E、肌苷、加兰他敏、三磷腺苷、苯丙酸诺龙以及中药等。适当的功能锻炼,进行各关节充分被动运动,针灸、推拿、按摩等均可延缓更严重的肌无力、肌萎缩和关节挛缩的发生。
积极预防和治疗呼吸道感染,对延长患者的存活时间是有价值的。国外报道采用皮质类固醇作为DMD的治疗,对改善患者的肌力和运动功能,延缓病程的进展有一定作用。但长期应用这类药物副作用较大,且其远期疗效如何。还需作进一步观察。
有关DMD的基因治疗,目前还限于动物试验阶段。由于Dys基因是迄今人类发现的最大基因之一,介导全长14kb cDNA进入肌肉细胞尚难以实施。以往采用的病毒或非病毒转基因系统,都存在着转移效率低以及其他问题。新近匹兹堡大学的研究人员构建出一种小于4.2kb微型Dys基因,可装载入腺病毒相关病毒载体,导入mdx鼠肌细胞,该转移系统可长期维持具有治疗意义的Dys蛋白表达,这是DMD基因治疗方面最为引人注目的进展。干细胞是一种能分化为多种组织细胞的始祖细胞,有报道静脉注射正常造血干细胞,可使mdx大鼠造血功能重建,并部分恢复受累肌细胞Dys的表达,因而干细胞移植在近年来也成为DMD治疗研究的又一热点。
(二)预后
不同类型,预后不同。参见临床表现,此处不赘述。
进行性肌营养不良症中医治疗
当前疾病暂无相关疗法。
1、饮食宜清淡、营养丰富,忌食或少食油腻厚味过热、伤津耗液及损伤脾胃之品,可多食鱼类、蛋类、鸡肉、瘦猪肉等,但不可太过,以免损伤脾胃。白菜、豆芽、西红柿、山楂、广柑、枣子之类的蔬菜水果可以适当多食一些。
2、坚持体育锻炼,自我按摩以增加活动,促进血液循环,防止肌肉萎缩,但应适度,不可过劳。积极与疾病作斗争,坚持适当的娱乐活动,促使患者建立乐观、开朗的情绪,树立以坚强毅力战胜疾病的信心。
3、采用力所能及的锻炼,亦不要过劳:上肢可练习抬举、俯卧撑、扩胸等;腰部可练习仰卧起坐;下肢可练习起蹲、上楼、跳跃、侧压腿等;注意防止挛缩,对膝关节、跟腱关节热敷后适当牵引;假肥大部位的按摩以揉法为主;防止脊柱畸形,保持良好坐姿,劳累后宜平卧休息。
4、进行性肌营养不良症容易头晕、面无血色,最好先补血,吃一些红枣炖猪蹄之类的营养丰富的食物,早餐喝牛奶用鸡蛋冲入热水中放一些红糖也可以喝。
预防本病的惟一有效手段是遗传咨询,产前诊断和选择性流产,特别对DMD/BMD,可采用生化方法,如血清CPK,Mb检测,有助于判定致病基因携带者,分子生物学技术的应用,如cDNA探针检测,PCR扩增,Dys印迹及免疫荧光检查等,大大提高了DMD/BMD致病基因携带者的检出率,并可用于产前基因诊断,这对控制本病的发生具有极重要的意义。
1.血生化检查
血清肌酸磷酸激酶(CPK)增高是重要而敏感的指标,以假性肥大型升高最明显,肢带型次之,面肩肱型轻度升高或正常,在假性肥大型的早期CPK增高最为显著,晚期活性下降,此外,血清肌红蛋白(Mb),丙酮酸激酶(PK)及乳酸脱氢酶(LDH)也是较敏感的指标,丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)也常升高,多种酶指标的联合测定更有利于相互参照。
2.尿肌酸测定
24h尿液肌酸排出量增高。
3.肌电图
松弛时可出现自发电位,轻收缩时运动单位电位的平均时限缩短,平均波幅降低,出现短棘波多相电位,强收缩时呈病理干扰相,峰值电压一般小于1000μV。
4.骨骼肌CT或MRI检查
通过多部位骨骼肌的CT或MRI影像检查可了解骨骼肌损害的分布范围和严重程度,有助于早期诊断和提供肌肉活检的优选部位。
5.肌活检
(1)形态学:光镜和电镜下显示骨骼肌的病理改变见前所述。
(2)骨骼肌基因产物——蛋白的测定:以相应蛋白的特异性抗体,应用免疫组化技术和免疫印迹技术检测骨骼肌中相应蛋白质的分布以及其质和量的变化,如Duchenne型肌营养不良的骨骼肌膜dystrophin几乎缺如。
6.心功能检查
90%DMD患者伴有心脏损害,一般心电图检查多可出现窦性心动过速,异常R波,V1导联S波变浅,深的Q波,P-R间期缩短以及束支传导阻滞等异常,Emery-Dreifuss肌营养不良在心功能检查方面常有心肌损害,心律失常和心脏传导障碍等异常表现,而在其他类型心脏受累均较少见。
7.基因检测
采取病人外周血,运用分子生物学技术,对致病基因进行直接检测或间接进行连锁分析,从DNA水平上进行诊断,如在Duchenne肌营养不良中检测外显子的缺失或其他类型的基因缺陷。
(1)DMD/BMD基因检测:在DMD基因缺陷中,有65%为缺失突变,5%为重复突变,其余为点突变及其他突变形式,目前,可针对其不同的突变形式采取不同的方法进行诊断:
①对于基因缺失和重复者,可联合应用多对引物进行多重PCR扩增。
②对于非缺失型,多采用PCR-STR连锁分析法。
③对于点突变者,可采用PCR-SSCP和DNA测序技术。
(2)FSHD基因检测:近年来研究发现,95%以上的FSHD病例与4q35区的3.3kb重复单位缺失,导致该区的一个EcoRI片段缩短有关,此片段可通过P13E-11探针经Southern杂交的方法进行检测,正常人此片段为35~300kb,患者由于上述缺失而小于35kb,因此,直接检测该片段大小可对本病进行基因诊断。
晚期,四肢挛缩,活动完全不能。常因伴发肺部感染,褥疮等于20岁之前丧生。智商常有不同程度减退,半数以上可伴心脏损害,心电图异常。早期呈现心肌肥大,除心悸外一般无症状。