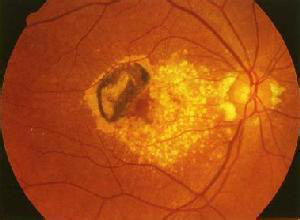
增龄性黄斑变性(age-related macular degeneration,ARMD),亦称老年性黄斑变性(senile macular degeneration,SMD)是与年龄相关的致盲的重要眼病之一;根据临床与病理表现,老年性黄斑变性分为2型,即萎缩型(atrophic senile macular degeneration)与渗出型(exudative senile macular degeneration)。萎缩型老年性黄斑变性主要为脉络膜毛细血管萎缩、玻璃膜增厚和视网膜色素上皮萎缩等所致的黄斑区萎缩变性;渗出型老年性黄斑变性主要为玻璃膜破坏脉络膜血管侵入视网膜下形成新生血管,导致视网膜和(或)色素上皮有浆液和(或)出血。
-
挂什么科:五官科 眼科
-
需做检查:裂隙灯 视力 眼底检查 眼底荧光血管造影
-
治疗方法:药物治疗 支持性治疗
-
常用药物:暂无相关信息
-
一般费用:根据不同医院,收费标准不一致,市三甲医院约(5000——10000元)
-
传染性:无传染性
-
治愈周期:3个月
-
治愈率:50%-70%%
-
患病比例:0.0025%
-
好发人群:见于老年人
-
相关症状:
-
相关疾病:
干性AMD由于RPE-Bruch膜-脉络膜毛细血管复合体的长期慢性进行性萎缩所致。
干性AMD多发生于50岁以上的老年人,双眼对称,视力极为缓慢的进行性下降,病人常有视物变形等症状,眼底检查双眼黄斑区色素紊乱,中心凹光反射消失,后极部有时常可见到一些大小不一,边界不很清晰的黄白色的玻璃膜疣,病程晚期有些病人由于RPE的萎缩及色素脱失,可见后极部视网膜有边界较为清晰的地图样萎缩区,如果脉络膜毛细血管也发生萎缩,就可以见到萎缩区内有一些粗大的脉络膜血管。
湿性AMD是由于Bruch膜受损,脉络膜毛细血管经由Bruch膜损害处向视网膜色素上皮及视网膜神经上皮处生长,形成脉络膜新生血管 (choroidal neovascularization,CNV),CNV一旦形成,由于新生血管的结构不完善,必将引起渗出,出血,机化,瘢痕等一系列病理改变,终致中心视力丧失殆尽。
湿性AMD多发生于60岁以上的老年人,多为一眼先发病,对侧眼可能在相当长的一段时间以后才发病,但也有少数病人双眼同时或先后不久发病,据国外大量的资料统计,单眼湿性AMD患者每年有12%~15%对侧眼发生湿性AMD,5年之内大约75%的病人对侧眼可能发病。
与干性AMD视力缓慢的进行性下降不同,湿性AMD病人发病后视力减退较为迅速,常于短期内明显下降,有些病人甚至可以明确指出其发病日期,然而眼底检查却可发现眼底后极部病变的范围已经非常广泛,大范围的病变绝非短期之内形成,因为病变虽然发生在后极部,但病变尚未影响中心凹,因此不少病人没有发现症状,一旦病变侵入中心凹,中心视力受损,病人才会发现视力下降。
湿性AMD依据其病程一般可分为3期:
1.早期或称为渗出前期 眼底检查后极部或黄斑区早期可有大小不等,边界模糊的黄白色渗出性玻璃膜疣,尤其是这些玻璃膜疣互相融合形成软性玻璃膜疣,这将是湿性AMD发生的先兆。
2.渗出期 病变进一步发展,CNV血管开始渗漏,眼底后极部可出现浆液性RPE脱离及浆液性视网膜神经上皮脱离,并可见灰白色的CNV,有时病变周围还可见到一些硬性渗出,如果CNV血管有出血,则可见视网膜出血以及视网膜下出血,出血位于视网膜浅层,则表现为鲜红色,出血位于视网膜深层则呈暗红色,如果出血时间较久,由于血红蛋白被分解吸收,出血区可逐渐变为黄色,如果出血位于视网膜色素上皮之下和脉络膜处,由于色素上皮和脉络膜的色素遮蔽,出血区则可表现为黑色,因而有时会被误诊为脉络膜黑色素瘤。
CNV的出血可能非常广泛,不仅局限于黄斑区,也可以占据整个后极部,更严重者甚至可以超出赤道部,形成一个范围巨大的黑色的隆起的病变,又称脉络膜血肿,因而常常可能被误诊为脉络膜黑色素瘤而被摘除眼球,如果出血量大,严重病例出血可以穿破视网膜内界膜,进入玻璃体引起玻璃体积血,大量的玻璃体积血甚至可以导致眼底不能检查,以后还可能发生牵引性视网膜脱离,继发性青光眼,新生血管性青光眼等更严重的并发症,临床上如果见到老年人突然发生大量玻璃体积血,眼底无法检查,而对侧眼黄斑区有玻璃膜疣,色素紊乱或典型的干性AMD表现,应当考虑为湿性AMD的大量出血。
3.瘢痕期 经过一段漫长的病程后,视网膜下的出血逐渐被吸收,而被伴随新生血管以及RPE化生的纤维组织所代替,病程晚期患者眼底后极部形成大片机化的瘢痕,眼底检查可见黄斑区或后极部有白色的机化膜及一些色素沉着,病人的中心视力丧失殆尽。
大约有16%的病人一段时间以后瘢痕周围可出现新的CNV,于是新一轮的渗出,出血,机化,瘢痕等病理改变再度重演,致使病变范围更行扩大。
当年龄在45岁以上的患者主诉视物变形,出现暗点,或近期视力下降时,应进行详细的临床检查,包括最佳的矫正视力及眼前段检查,视野检查,裂隙灯显微镜配合用三面镜及检影镜,以及间接检眼镜仔细检查眼底,必要时可采用黄斑立体照相,Amsler方格表能查出视物变形及暗点,中心视野有任何障碍的病人应速作检查,若视网膜下有液体,出血,黄色渗出,或脂性沉积物及灰绿色脉络膜病变而裂隙灯或检眼镜不能肯定,则应作荧光血管造影,脉络膜新生血管发现早,可以治疗的机会就多,以便决定是否光凝,一眼黄斑有本病的患者每年应检查眼底2次,可治的脉络膜新生血管有时间从属性,因本病在视力迅速丧失出现后第1个月内是可以治疗的,大部分脉络膜新生血管开始都在中心凹外,但不久便扩展到中心凹无血管区下面,故应尽早发现并及时治疗。
本病的晚期诊断一般不难,关键是早期诊断,本病的早期常无任何症状,回顾性的研究本病的早期症状,依次是视物模糊,视物变形,阅读困难,中心或旁中心暗点及视力疲劳,Andrew 研究了103个本病早期脉络膜新生血管引起的症状,以视物变形和近距离阅读困难是本病最早期的症状,出现上述自觉症状时要仔细检查病人,临床中也发现近视很少患本病,大部分患者屈光为正视及远视改变,因此本病可加重视力疲劳和近距离阅读困难,检查本病的近视力更易发现中心视力的变化。
(一)发病原因
增龄性黄斑变性的发病原因目前尚不清楚,但据大量流行病学调查资料,多年来的临床病例分析,以及各种动物实验的研究表明,可能引起增龄性黄斑变性的因素有:遗传因素,环境影响,先天性缺陷,后极部视网膜慢性光损伤,营养失调,免疫或自身免疫性疾病,炎症,代谢障碍,巩膜硬度的改变,中毒,心血管系统疾病等多种因素,其中黄斑区视网膜长期慢性的光损伤,可能是引起黄斑区的视网膜色素上皮(retinal pigment epithelium,RPE)及光感受器发生变性的重要基础,但迄今为止还没有明确的证据可以证明是什么原因直接引起增龄性黄斑变性,本病很可能是多种因素长期共同影响的结果。
(二)发病机制
衰老和退变是引起增龄性黄斑变性的重要因素,人的一生中,RPE负担着为视网膜外层组织提供营养,维持新陈代谢的重要功能,有吞噬及消化光感受器外节盘膜的新陈代谢的复杂的生化功能,RPE吞噬了大量的光感受器外节盘膜以后,利用RPE细胞内的线粒体,溶酶体,滑面内质网,粗面内质网以及Golgi 体等细胞器,消化,再回收外节盘膜的有用物质,而不能消化的物质形成一些残余体——脂褐质(lipofuscin)存积在RPE细胞内,随着年龄的增长,RPE的吞噬和消化光感受器外节盘膜的功能也逐渐减退,致使不能消化的残余体越来越多,RPE内的脂褐质随着年龄的增长越来越增多,残余的代谢产物不断从RPE细胞内向底部排出。
慢慢地存积在RPE与Bruch膜之间,形成大量的玻璃膜疣(drusen),进而引起RPE-Bruch膜-脉络膜毛细血管复合体变性,致使黄斑区和后极部视网膜脉络膜发生萎缩,也可进一步引起Bruch膜内胶原层增厚以及弹力纤维层断裂,致使脉络膜的毛细血管通过裂损的Bruch膜进入RPE下及视网膜神经上皮下,形成视网膜下新生血管(subretinal neovascularization,SRNV)或称脉络膜新生血管(choroidal neovascularization,CNV),CNV一旦形成,由于新生血管的结构不良,必然会发生血管的渗漏和出血,因而引发一系列的继发性病理改变,同时伴随着新生血管的进入,血管周围必然会同时有结缔组织的增生,将整个后极部视网膜脉络膜组织完全破坏,最终黄斑区及后极部产生大量瘢痕。
诊断标准
本病一般双眼发病,一眼患病,第二眼具有发生本病的高度危险性,对单侧本病患者进行色调分辨力,黄斑阈值,暗适应检查及Amsler表中心视野检查,4项检查结果均反映当单侧本病对侧眼视力≥1.0时,已有视功能异常,表现为色调分辨力及视网膜光敏感度的降低,暗适应功能及Amsler表中心视野的异常,Eisner发现晚期本病第二眼视力正常,无黄斑病变,但有蓝锥细胞敏感性降低和色觉改变,中心凹视锥细胞视色素密度比正常眼减少,因而对另一眼有晚期本病的早期本病患者,尤其另一眼有大量的融合性玻璃膜疣,要注意早期检查和早期诊断。
鉴别诊断
干性AMD应与Stargardt病和中心性晕轮状视网膜脉络膜萎缩等疾病相鉴别,Stargardt病多发生于青少年期,发病年龄多在10多岁左右,自幼即有视力进行性减退,眼底表现为后极部有椭圆形的视网膜脉络膜萎缩病灶,不少病人同时伴有视网膜黄白色斑点;中心性晕轮状视网膜脉络膜萎缩发病年龄多数也在10多岁,视力障碍由来已久,眼底检查常伴有视盘周围的脉络膜萎缩,干性AMD病人以往视力一直正常,视力减退多在年老以后,发病时间与病程迥然相异。
湿性AMD应与中心性渗出性脉络膜视网膜炎,高度近视眼的黄斑退变引起的CNV,眼底血管样条纹,脉络膜黑色素瘤等疾病相鉴别,中心性渗出性脉络膜视网膜炎多发生于年轻女性,单眼发病,病变范围很小,通常为1/3~1/2视盘直径大小;高度近视患者有高度近视的历史,眼底检查可见豹纹状眼底,巩膜后葡萄肿以及漆纹样裂纹;眼底血管样条纹可见视盘周围有棕黑色的向四周发出的放射状的条纹,其中走向眼底后极部的条纹可发生CNV,眼底荧光素血管造影可以见到非常醒目的血管样条纹;脉络膜黑色素瘤眼底荧光素血管造影表现为造影早期为遮蔽荧光,但造影后期可见病变边缘有多数细小的强荧光小点,以后有荧光素渗漏,有时可以见到肿瘤内的血管与视网膜血管同时显影,形成双循环现象,眼部超声检查也可协助诊断,仔细分析,结合眼底荧光素血管造影,超声波检查等手段当可鉴别上述疾病。
增龄性黄斑变性西医治疗
(一)治疗
干性AMD由于是RPE-Bruch膜-脉络膜毛细血管复合体的退行性改变引起,因而目前尚无任何治疗方法。所幸本病病变仅限于后极部黄斑区,因此仅中心视力受损,而周围视力不受影响,所以病人一般日常生活还可自理。中心视力障碍可用助视器帮助。可介绍病人去低视力门诊诊治,远视力可佩戴远用助视器即望远镜式眼镜,近视力可借助近用助视器即放大镜类帮助阅读。但有些干性AMD病人一段时间以后,可产生CNV,因而转化为湿性AMD,从而病变范围不断扩大,所以干性AMD病人也应当定期复查,以便及早发现CNV,及时予以处理。
湿性AMD的处理原则是尽早处理CNV,避免病变不断扩大,损害更多的中心视力。如果治疗得当,治疗成功,可以保持病人现有视力。不少病人由于控制了CNV,病变附近的渗出、出血被吸收,视力还可以有一些进步。对于那些单眼的湿性AMD,而对侧眼仍然健康者,一方面应积极治疗患眼,对侧眼也应当密切观察,可请病人使用Amsler表每天自行检查其健眼的中心视野,如果一旦发现健眼有Amsler表的方格扭曲、出现暗点或视物变形等现象,应立即到医院检查,以便及早治疗。
对湿性AMD治疗的最终目的是封闭CNV,因此任何可以使CNV消除或萎缩的方法,都可以阻止其所引起的出血、渗出以及机化瘢痕的形成,使现有的视功能得以保存。如果CNV被成功的封闭,就能停止渗漏和出血,病变不再继续发展,原有的病变机化为瘢痕,可保持现有的视力。治疗湿性AMD的方法现有激光光凝、黄斑下CNV摘除、黄斑手术转位、经瞳孔温热疗法以及光动力疗法等,根据病人的具体情况不同而有不同的选择。
1.激光光凝 应用激光光凝CNV是AMD的经典性治疗方法。激光光凝可以封闭CNV,从而控制疾病的发展,达到一定的治疗效果。然而对于位于中心凹的CNV,就不能使用激光光凝,否则CNV虽然得到了治疗,但CNV浅层的视网膜光感受器也将荡然无存,最终中心视力必然丧失。截至目前,国内、外对黄斑中心凹以外的CNV的治疗,激光光凝仍不失为一种有效的治疗手段。但光凝不能阻止新的CNV形成,此外光凝后CNV的复发率也较高(>50%),这使得光凝治疗结果并不理想。对位于黄斑中心凹无血管区外750μm的边界清楚的CNV,选择氪黄激光光凝治疗是相对安全的。近年来,有人在吲哚青绿造影引导下寻找CNV的滋养血管,通过直接光凝滋养血管使CNV逐渐萎缩,这一方法可以减少激光光凝对视网膜的损伤并且可以重复治疗。
2.黄斑下CNV摘除(submacular surgical removal of CNV) 是20世纪90年代后期开展的手术治疗AMD的新方法。先行玻璃体切割术,然后在后极部切开视网膜,在视网膜下间隙取出CNV。此手术技术要求较高,术中、术后并发症较多,大多数病例术后视力恢复也不理想。因为虽然取出了CNV,但CNV和手术引起的视网膜光感受器和RPE的损害不可逆转。美国视网膜下手术治疗研究组总结了到1997年为止所作的黄斑下CNV摘除70例的对照研究,其中36例随机的选择了激光光凝治疗,34例行黄斑下CNV摘除术。与激光治疗组相比,治疗后2年,手术治疗组病例平均视力下降2行,而激光组视力保持不变。因此,美国视网膜下手术治疗研究组的结论是手术摘除黄斑下CNV与激光治疗相比并没有优点。但他们自2000年起仍在继续作这方面的为期5年的、多中心的研究工作,以期得出更科学的结论。国内少数医学院校也曾开展了少量病例治疗,目前还缺乏长期的随访资料。
3.黄斑转位手术(macular translocation) 也是最近才开始的治疗AMD的新方法。手术在玻璃体切割术的基础上,将视网膜与色素上皮分离,通过视网膜切开或巩膜缩短将黄斑中心区视网膜转位而离开原来发生CNV的区域,然后使用激光光凝CNV。这样黄斑区视网膜光感受器将不受损害,并使其能得到健康的RPE的支持,从而保持一定视力。这种方法手术技术要求较高,术中、术后并发症较多,手术风险较大。术后视力由于黄斑区已经转位,必然导致双眼视的混淆或复视,因而必须再行眼肌手术以矫正眼位。1999年Lewis等报告了10例10只眼黄斑转位病例,术后半年4只眼视力进步,6只眼视力下降。由于手术的不可预测性和手术可能带来的并发症,还需要改进手术的技巧和方法。2002年欧洲一组医师报告了90例黄斑转位手术,术后12个月视力进步者24例,37例视力保持稳定,视力下降者29例。90例中17例发生严重并发症做了2次手术,17眼术后有增殖性玻璃体视网膜病变,5眼发生视网膜前膜,1眼发生黄斑裂孔。结论是黄斑转位术的技术性非常高,并发症多,但确可取得一定的疗效。因此,行手术者需要有坚实的玻璃体视网膜手术基础。国内也有少数医院已经开始开展黄斑转位手术,对于这一手术也应当慎行,在少数有条件的医院可以谨慎选择病例,进行随机的、双盲的、多中心的研究。
4.经瞳孔温热疗法(TTT) 是近年来开始用于治疗AMD的新方法。应用810nm波长的半导体红外激光照射病变区,使局部温度升高,以达到治疗黄斑区CNV的目的。TTT治疗可使照射区温度升高5~10℃,以封闭CNV。与传统的激光光凝不同,TTT由于温度升高较为温和,因此对邻近组织损伤不大。传统的激光光凝使局部温度在极短期内升高42℃。因此造成被照射区的一切组织损伤,不仅CNV受到破坏,CNV邻近的组织也受到破坏。TTT的治疗原理可能是使血管内血栓形成或促使细胞凋亡,或者是由于温度抑制了血管生成因子的作用。虽然目前认为TTT治疗对正常组织没有太大的损害,然而TTT治疗毕竟是一种非特异性的治疗,它既作用于病变组织,也必然会作用于病变周围的组织。因此,TTT是否会对正常组织有长远的晚期反应,现在还不能肯定,还需要较长期的、大量数据的证实,以及多中心、随机和双盲的研究的结论。我国不少医院正在开展TTT治疗眼底疾病,希望能够谨慎的选择病例,进行严格细致的临床观察,以及设有对照的系统研究,以期能够得出比较科学的结论。
5.光动力疗法(PDT) 自1995年以来,人们通过动物实验和临床观察,应用PDT对继发于AMD的CNV的治疗效果进行了一系列研究。经过近3年的动物实验和临床观察,1998年,人们开始对PDT对CNV的作用进行多中心的1期、2期以及3期临床研究,又经近3年的临床研究,美国FDA于2000年4月正式批准PDT用于治疗老年黄斑变性。我国也于2000年6月开始引进PDT治疗老年黄斑变性病人。我们在国内经过3年的临床应用,也证实PDT确实有较满意的效果。PDT治疗是从静脉内泵入一种特殊的光敏剂Visudyne,然后利用689nm波长的激光照射CNV区域。
由于Visudyne中的光敏活性成分verteporfin极易与低密度脂蛋白结合,而CNV的血管内皮细胞中含有大量的低密度脂蛋白受体,因此verteporfin大量聚集在CNV中,受到特定的波长的光照射后,从基态激发为激发态,在向基态或三重态转化过程中,释放能量并传递给氧,经Ⅰ型和Ⅱ型光化学反应生成氧自由基和(或)单线态氧,进而损伤新生血管内皮细胞,导致血管封闭、萎缩。PDT治疗可以用于黄斑中心凹下的典型性为主或无典型性成分的CNV,与玻璃体切割手术和传统激光相比,PDT治疗可以更有效的减缓CNV引起的视力下降。但是PDT治疗也不能阻止CNV的复发和再生,常常需重复治疗,第1年平均治疗次数是3.4次,第2年2.1次。3年内平均7次。由于PDT治疗中的激光在局部升温不超过2℃,对视网膜不会造成不可逆性损伤,所以安全性高,并且可以重复治疗。正因为如此,它还可用于激光、手术或放射治疗等其他方法失败或复发后的再治疗。相信随着大量的临床研究,PDT治疗必将能够更加完善。
6.药物治疗 通过口服或玻璃体腔内注射抗新生血管因子药物,抑制新生血管的生长促进其萎缩,目前还处于动物和临床试验阶段,尚无明确效果。还有表明研究玻璃体腔内注射长效类固醇激素,可以取得一定疗效。有人利用生长的血管比成熟血管对放射离子敏感得多这一原理,通过外放射或巩膜外敷贴放射治疗隐匿性CNV,认为可减少CNV的渗漏。
(二)预后
对于干性AMD患者晚期可出现中心视力丧失,周边视力尚可,无其他并发症不致全盲。对于已经发展成湿性AMD的病人,由于容易发生黄斑区视网膜下出血,视力预后不容乐观。早期发现和积极治疗成为影响预后的重要因素。
增龄性黄斑变性中医治疗
暂无可参考数据。
增龄性黄斑变性日常保健
平时可以多吃一些维生素含量高的食物,这样也让身体吸收一些营养。
增龄性黄斑变性日常预防
由于本病目前尚无特殊的治疗方法,在早期有人认为内服锌剂可以防止黄斑变性的进展,而抗氧化剂如维生素C、E可防止自由基对细胞的损害,保护视细胞,起到视网膜组织营养剂的作用,多数学者主张对渗出型者,应及早施行激光光凝新生血管,以避免病情恶化。
1.眼底血管造影 常用于诊断眼底疾病的眼底血管造影多年来仅为眼底荧光素血管造影(FFA),近年来又发明了吲哚青绿血管造影(ICGA),前者主要用于诊断视网膜血管疾病,对脉络膜血管疾病的诊断不够理想;后者主要用于脉络膜血管疾病的诊断,临床上使用FFA和ICGA联合造影,大大提高了眼底疾病的诊断水平。
干性AMD眼底荧光素血管造影,表现为造影早期后极部由于RPE的萎缩而显现透见荧光,多数玻璃膜疣也显现透见荧光,少数玻璃膜疣可能显现荧光素染色,如果后极部RPE有地图样萎缩,造影则可见局部地图样透见荧光,如果病程后期脉络膜毛细血管也发生萎缩,则在局部弱荧光的背景上显现有粗大的脉络膜血管。
干性AMD吲哚青绿脉络膜血管造影中玻璃膜疣从始至终均表现为遮蔽荧光。
湿性AMD眼底荧光素血管造影,于造影的早期即动脉前期或动脉早期即显现花边状,车辐状,绒球状或网状的CNV的形态,很快即有明显的荧光素渗漏,致使CNV形成一片强荧光,周围的出血显现荧光遮蔽,晚期瘢痕形成,眼底荧光素血管造影表现为造影早期瘢痕区为弱荧光,但造影后期瘢痕可以染色,形成一片强荧光。
根据眼底荧光素血管造影CNV的显影情况,临床上将之分为典型性CNV与隐匿性CNV两种,所谓的典型性CNV是指在造影早期即显出清晰的CNV的形态,并且很快就有荧光素渗漏,以后即形成一片强荧光的病变,而所谓隐匿性CNV是指由于病灶区的浓厚的出血,脂质渗出,色素或瘢痕的遮蔽,在血管造影的早期CNV显影不完全,仅为一些边界不清的斑驳荧光,中后期荧光逐渐增强,晚期显现荧光素渗漏。
此外,根据眼底立体图像见到有无RPE的隆起又将隐匿性CNV分为纤维血管性RPE脱离(fibro-vascular pigment epithelial detachment)以及晚期无源性渗漏(late leakage of undetermined origin)2种类型,前者眼底荧光素血管造影在染料注射后1~2min后出现点状强荧光点,晚期有界限较为清晰的荧光素渗漏区;后者大约在染料注射后 2~5min才出现荧光素渗漏,早期影像却无任何异常荧光表现,很难查见渗漏的源头,晚期渗漏的边界也不清晰。
湿性AMD吲哚青绿脉络膜血管造影往往与FFA不同,变化较多,可以表现为热点或异常粗大的脉络膜血管,由于吲哚青绿荧光不受视网膜及脉络膜出血的影响,有时较FFA更能完整的显示出CNV的形态和范围,甚至在造影早期即可观察到快速充盈又迅速流空的CNV滋养血管,但也可能在 FFA中显示为异常强荧光的部位,在ICGA中却无阳性发现,因此典型性CNV和隐匿性CNV是单纯的眼底荧光素血管造影的概念,不适用于吲哚青绿脉络膜血管造影的分析,此外,由于ICGA的荧光强度较FFA低,所以ICGA中CNV的渗漏往往不像其在FFA中明显。
2.光学相干断层扫描术 干性老年性黄斑变性的OCT图像主要表现为上,下血管弓内特别是黄斑区的视网膜神经上皮层变薄,各层光反射强度轻微增强或减弱,呈红色反光带的视网膜色素上皮/脉络膜毛细血管层出现几个或多个大小不等的半弧形隆起,与眼底像中的玻璃膜疣相对应。
湿性AMD的CNV引起的渗出,出血,瘢痕在OCT中分别有如下表现:
(1)CNV:
①典型性CNV:OCT表现为视网膜色素上皮/脉络膜毛细血管层的红色反射光带,局限性增厚,较小的CNV通常表现为梭形的红色反光团,大的CNV则是较大范围的不规则增厚,同时伴有视网膜色素上皮/脉络膜毛细血管层的变形,境界清楚,如果CNV突破色素上皮层进入视网膜下,OCT表现为神经上皮腔隙下的红色反光团,CNV的滋养血管则表现为视网膜色素上皮/脉络膜毛细血管层中断,红色反光带垂直或斜行伸入神经上皮下,并可见其血管分支 。
②隐匿型CNV:约占85%,OCT表现相似,仅边界不清。
(2)出血和渗出:在湿性AMD的病灶中常有出血和渗出而导致浆液性和(或)出血性的视网膜下和(或)色素上皮脱离,浆液性脱离表现为液体聚集形成的无反光的腔隙,出血在OCT图像中呈中等度的强反射,并遮蔽其后的组织,出血性脱离,如在视网膜下,其脱离的神经上皮黄绿光反射光带前缘不清楚,脱离区内可见不规则的高反射点或区,色素上皮光带可部分或全部遮蔽,部分患者由于有大量的渗出和出血,可形成黄斑囊样水肿。
(3)瘢痕:OCT表现为视网膜色素上皮/脉络膜毛细血管层光带局限性增厚,边界较清楚,且反光增强,如瘢痕中有色素,则部分遮挡其后脉络膜的光带,此外,瘢痕上方的视网膜组织通常因萎缩而变薄。
3.玻璃膜疣的分类 玻璃膜疣在数量,大小,形状,分布,色素以及隆起程度等方面均有所不同,以下几种类型的玻璃膜疣已经得到临床和组织病理学的证实:
(1)硬性玻璃膜疣(hard drusen):眼底镜下此型玻璃膜疣为小的散在的圆形,黄白色沉积物出现在眼底后极部,可伴有覆盖于其表面的视网膜色素上皮色素的缺乏和(或)周围的视网膜色素上皮的肥大,这些所伴发的色素改变有助于用眼底镜检查发现玻璃膜疣。
(2)软性[弥漫性,融合性,浆液性(diffuse,confluent,serous)]玻璃膜疣(soft dursen):软性玻璃膜疣通常为大的无定形结构的黄色沉积物,形状不规则,大小不定,有软性外观,具有不清晰的边缘,位于视网膜深层,常常趋于融合,当软性玻璃膜疣变大并融合时,它酷似视网膜色素上皮浆液性脱离,在此时期伴发的色素改变(色素过多,减少或缺乏)也可能更为显著,当玻璃膜疣变成融合时,血管受侵以及相邻的RPE和感光细胞退行性变的危险性增加。
(3)半固体的(混合的,浆液颗粒性的,mixed,serogranular)玻璃膜疣(semisolid drusen):Sark用混合性玻璃膜疣来描述一个同时具有硬性和软性玻璃膜疣特征的玻璃膜疣,眼底镜检查该种玻璃膜疣可具有类似软性玻璃膜疣样模糊边缘,但却显出硬性玻璃膜疣那样相当平的外观,Bressler等主张将混合性玻璃膜疣用于硬性和软性玻璃膜疣的眼,用半固体玻璃膜疣来描述具有显示较典型的软性玻璃膜疣,扁平且更具有萎缩特点的玻璃膜疣眼。
(4)基底膜(结节的,nodular)玻璃膜疣(basal laminar drusen):它具有数不清的,小而均匀一致的,散在的圆形,轻度隆起的黄色视网膜下病变的特点,用后部反光照明法,这些玻璃膜疣表现为半透明的结节状结构,与硬性,软性或半固体玻璃膜疣不同,基底膜玻璃膜疣见于较年轻的患者,它伴(偶伴)有小的,黄色渗出性脱离,不应与基底膜沉积物相混淆。
(5)钙化的玻璃膜疣(calcified drusen):为硬性沉积物,具有闪光的外观,常为一区域性视网膜色素上皮萎缩所围绕。
1.局灶性萎缩斑 玻璃膜疣发展的结果是视网膜色素上皮消失,产生萎缩区,此时玻璃膜疣亦消失,最后导致萎缩区与脉络膜毛细血管功能不全,可能是产生萎缩的原因,在脉络膜新生血管的患者中,34.8%同时具有视网膜色素上皮萎缩斑。
2.视网膜色素上皮脱离 视网膜色素上皮浆液性脱离是黄斑变性的一种渗出性并发症,由于内层Bruch膜弥漫性增厚而容易产生裂隙,这种裂隙实际是Bruch膜内部彼此之间的脱离,使脉络膜新生血管发生的危险性增加。
3.脉络膜新生血管形成 软性玻璃膜疣容易形成脉络膜新生血管,荧光血管造影时有进行性渗漏的大的融合性玻璃膜疣的眼,发生盘状变性的危险性较大,有融合性玻璃膜疣及黄斑区有局灶性色素增生发生脉络膜新生血管及其并发症的危险性较大。
4.盘状瘢痕(disciform scar) 黄斑区发生盘状瘢痕是脉络膜新生血管的最主要结局,位于增厚的内层Bruch膜产生裂隙,新生血管侵入,薄壁的新生血管常发生出血及渗出,因而导致视网膜色素上皮及内层Bruch膜发生浆液性及出血脱离,并使两层组织之间有纤维组织增生,使纤维血管瘢痕组织形成。
5.其他 黄斑盘状瘢痕的患者还可发生其他并发症,如视网膜内或视网膜下广泛渗出(有时称之为老年性Coats反应)和邻近的视网膜和(或)视网膜色素上皮的浆液性和(或)出血性脱离,个别病例如缓慢发展的浆液性和(或)出血性脱离可波及到脉络膜动,静脉,进入盘状瘢痕的区域内。